Substâncias Simples E Compostas – Mundo Educação: este tópico introduz o fascinante mundo da química, explorando a distinção fundamental entre substâncias simples, formadas por apenas um tipo de átomo, e substâncias compostas, resultantes da combinação de dois ou mais tipos de átomos. A compreensão dessa diferença é crucial para decifrar as propriedades e comportamentos da matéria ao nosso redor, desde os metais mais resistentes até os gases que respiramos.
Analisaremos a composição atômica, as propriedades físicas e químicas, e as reações que envolvem esses dois tipos de substâncias, utilizando exemplos do cotidiano para ilustrar os conceitos.
A partir da análise da estrutura atômica, exploraremos a formação de ligações químicas – iônica, covalente e metálica – como o alicerce da formação de substâncias compostas a partir de substâncias simples. Veremos como diferentes tipos de ligações resultam em propriedades distintas e como essas propriedades influenciam as reações químicas, como as reações de síntese, decomposição, combustão e neutralização.
O estudo abrangerá exemplos práticos, tabelas comparativas e equações químicas balanceadas, visando fornecer uma base sólida para a compreensão da química básica.
Definição e Diferenças entre Substâncias Simples e Compostas: Substâncias Simples E Compostas – Mundo Educação
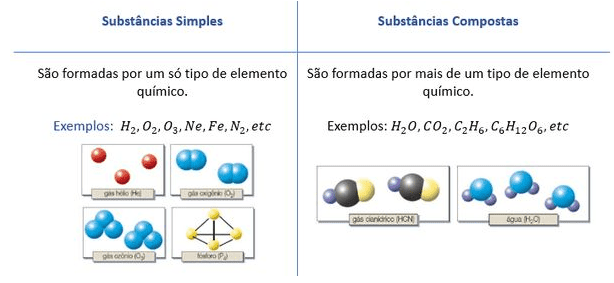
Substâncias simples e compostas são categorias fundamentais na química que descrevem a composição da matéria. A distinção crucial reside no tipo de átomos que constituem a substância. Compreender essa diferença é essencial para interpretar as propriedades e o comportamento de diferentes materiais.
Composição Atômica de Substâncias Simples e Compostas
Substâncias simples são formadas por átomos de um único elemento químico. Isso significa que todos os átomos presentes na substância são idênticos, possuindo o mesmo número atômico. Por exemplo, o oxigênio gasoso (O 2) é uma substância simples, pois é composta apenas por átomos de oxigênio. Já as substâncias compostas são formadas por átomos de dois ou mais elementos químicos diferentes, unidos por ligações químicas.
A água (H 2O), por exemplo, é uma substância composta, pois contém átomos de hidrogênio e oxigênio.Podemos representar isso graficamente: Substância Simples (Oxigênio): Imagine dois círculos idênticos, representando átomos de oxigênio, ligados entre si. Cada círculo possui o símbolo “O” em seu interior. Substância Composta (Água): Imagine dois círculos menores, representando átomos de hidrogênio (com o símbolo “H” em seu interior), ligados a um círculo maior, representando um átomo de oxigênio (com o símbolo “O” em seu interior).
A ligação entre os átomos é representada por uma linha entre os círculos.
Tabela Comparativa de Substâncias Simples e Compostas
A tabela abaixo resume as diferenças entre substâncias simples e compostas, fornecendo exemplos relevantes.
| Nome da Substância | Tipo (Simples ou Composta) | Fórmula Química | Exemplos |
|---|---|---|---|
| Oxigênio | Simples | O2 | Gás oxigênio na atmosfera, utilizado na respiração |
| Ferro | Simples | Fe | Ferro utilizado em estruturas, utensílios e aço |
| Água | Composta | H2O | Água potável, água do mar, gelo |
| Glicose | Composta | C6H12O6 | Açúcar presente em frutas e mel, fonte de energia para as células |
Propriedades Físicas e Químicas de Substâncias Simples e Compostas
As propriedades físicas, como ponto de fusão e ebulição, e as propriedades químicas, como reatividade, variam significativamente entre substâncias simples e compostas. Substâncias simples, como metais, podem apresentar altos pontos de fusão e ebulição, enquanto substâncias compostas podem ter pontos de fusão e ebulição mais baixos ou mais altos, dependendo de sua estrutura molecular e das forças intermoleculares presentes.
A reatividade também difere; algumas substâncias simples são altamente reativas (como o sódio metálico), enquanto outras são menos reativas (como o ouro). Substâncias compostas exibem uma ampla gama de reatividades, dependendo de sua composição e estrutura. Por exemplo, a água é relativamente estável, enquanto outros compostos, como o nitroglicerina, são altamente explosivos. A reatividade está diretamente relacionada à força das ligações químicas presentes na substância.
Reações Químicas envolvendo Substâncias Simples e Compostas

As substâncias simples e compostas participam ativamente de diversas reações químicas, que são processos que envolvem a transformação de substâncias em outras, com rearranjo de átomos e formação ou quebra de ligações químicas. Compreender essas reações é fundamental para a química, permitindo a previsão e manipulação de transformações da matéria.
Reações de Síntese e Decomposição
As reações de síntese e decomposição são exemplos clássicos que ilustram a interação entre substâncias simples e compostas. Nas reações de síntese, duas ou mais substâncias reagem para formar uma única substância mais complexa. Já nas reações de decomposição, uma substância se fragmenta em duas ou mais substâncias mais simples.
Exemplo de reação de síntese (formação de água):
2H 2(g) + O 2(g) → 2H 2O(l)
Nessa reação, duas substâncias simples (hidrogênio e oxigênio gasosos) reagem para formar uma substância composta (água líquida).
Exemplo de reação de decomposição (decomposição da água):
2H 2O(l) → 2H 2(g) + O 2(g)
Aqui, uma substância composta (água líquida) se decompõe em duas substâncias simples (hidrogênio e oxigênio gasosos). Note que a reação de decomposição é o inverso da reação de síntese.
Formação de Substâncias Compostas a partir de Substâncias Simples
A formação de uma substância composta a partir de substâncias simples envolve a formação de ligações químicas entre os átomos dos elementos constituintes. O tipo de ligação química (iônica, covalente ou metálica) determina as propriedades físicas e químicas da substância composta formada.
Em uma ligação iônica, ocorre a transferência de elétrons de um átomo para outro, resultando em íons com cargas opostas que se atraem eletrostaticamente. Um exemplo é a formação do cloreto de sódio (NaCl) a partir do sódio metálico (Na) e do cloro gasoso (Cl 2):
2Na(s) + Cl 2(g) → 2NaCl(s)
Em uma ligação covalente, os átomos compartilham elétrons para atingir a estabilidade eletrônica. A formação da molécula de água (H 2O) a partir de hidrogênio (H 2) e oxigênio (O 2) é um exemplo clássico de ligação covalente:
2H 2(g) + O 2(g) → 2H 2O(l)
Ligações metálicas ocorrem entre átomos de metais, onde os elétrons de valência são deslocalizados, formando uma “nuvem” de elétrons que une os átomos. A formação de ligas metálicas, como o latão (uma mistura de cobre e zinco), ilustra esse tipo de ligação.
A natureza das ligações químicas é fundamental para determinar as propriedades das substâncias. A força e o tipo de ligação influenciam diretamente os pontos de fusão, ebulição, solubilidade e reatividade química.
Reagentes e Produtos em Reações Químicas, Substâncias Simples E Compostas – Mundo Educação
Em qualquer reação química, as substâncias que reagem são denominadas reagentes, e as substâncias que são formadas são os produtos. As reações de combustão e neutralização são exemplos relevantes envolvendo substâncias simples e compostas.
Reações de combustão envolvem a reação rápida de uma substância com o oxigênio, geralmente produzindo calor e luz. A combustão do metano (CH 4), um composto orgânico, é um exemplo:
CH 4(g) + 2O 2(g) → CO 2(g) + 2H 2O(l)
Neste caso, o metano e o oxigênio são os reagentes, enquanto o dióxido de carbono e a água são os produtos.
Reações de neutralização envolvem a reação entre um ácido e uma base, produzindo sal e água. A reação entre o ácido clorídrico (HCl) e o hidróxido de sódio (NaOH) é um exemplo:
HCl(aq) + NaOH(aq) → NaCl(aq) + H 2O(l)
O ácido clorídrico e o hidróxido de sódio são os reagentes, e o cloreto de sódio e a água são os produtos.
Em resumo, a distinção entre substâncias simples e compostas é fundamental para a compreensão da química. A análise da composição atômica, das ligações químicas e das reações que envolvem esses tipos de substâncias revela a complexidade e a beleza da matéria. A capacidade de identificar e classificar substâncias simples e compostas, bem como prever seu comportamento em reações químicas, é uma habilidade essencial para diversos campos científicos e tecnológicos.
Este estudo fornece uma base sólida para aprofundar o conhecimento em química e suas aplicações práticas.

