Modelo Atômico De Bohr – Características, Composição E Exercícios: embarque conosco numa jornada fascinante ao coração da matéria! Vamos desvendar os mistérios do átomo através da lente brilhante do modelo proposto por Niels Bohr, um marco na história da física que revolucionou nossa compreensão da estrutura atômica. Exploraremos suas características principais, comparando-o com modelos anteriores e revelando a elegância de seus postulados.
Desvendaremos a composição atômica segundo Bohr, analisando as partículas subatômicas e suas interações, e culminaremos com exercícios práticos que solidificarão seu aprendizado. Prepare-se para uma imersão completa no universo atômico!
A viagem começa com a análise das características centrais do modelo de Bohr, focando nos níveis de energia quantizados e na relação entre a emissão de luz e as transições eletrônicas. Em seguida, iremos desvendar a estrutura atômica segundo Bohr, comparando-a com o modelo atual e ilustrando com exemplos como o átomo de hidrogênio e o de hélio. Finalmente, aplicaremos o conhecimento adquirido em exercícios que demonstram a capacidade do modelo de explicar fenômenos como o espectro de emissão do hidrogênio e a formação de íons.
A cada etapa, a complexidade da estrutura atômica se revelará, iluminando o caminho para uma compreensão mais profunda do mundo que nos cerca.
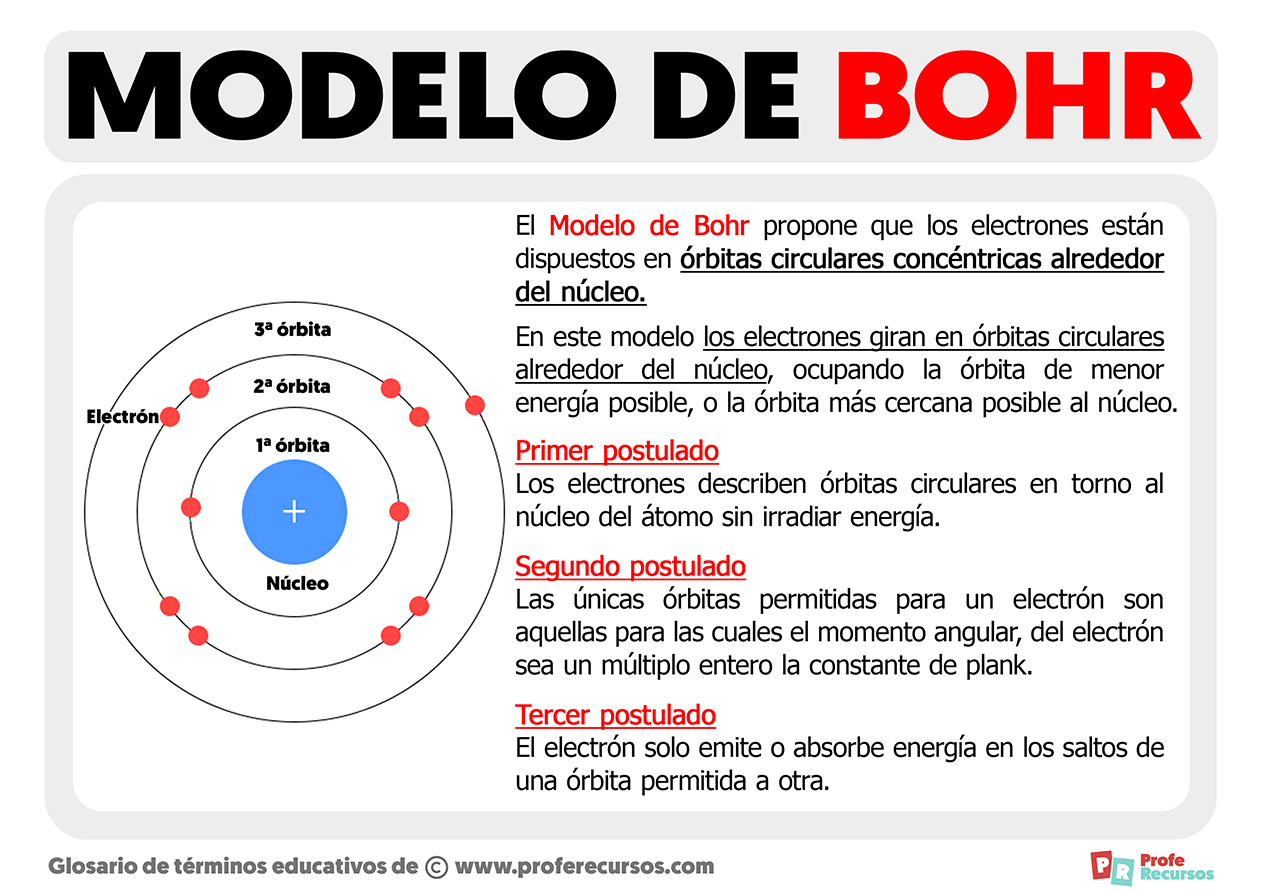
Composição do Átomo segundo Bohr
Embarque conosco numa viagem fascinante ao coração da matéria, explorando a visão revolucionária de Niels Bohr sobre a estrutura atômica. Seu modelo, apesar de superado por teorias mais complexas, representou um salto monumental no entendimento do átomo, lançando as bases para a mecânica quântica. Vamos desvendar os componentes fundamentais do átomo segundo Bohr, sua organização e as limitações dessa perspectiva, comparando-a com o conhecimento atual.
O modelo atômico de Bohr, proposto em 1913, introduziu a ideia de órbitas eletrônicas quantizadas, revolucionando a compreensão da estrutura atômica. Antes de Bohr, a imagem do átomo era nebulosa, uma mistura de partículas positivas e negativas sem uma organização definida. Bohr, inspirando-se na teoria quântica de Planck, postulou que os elétrons giravam ao redor do núcleo em órbitas específicas, com níveis de energia definidos.
Esta proposta elegante, embora simplificada, explicou com sucesso o espectro de emissão do átomo de hidrogênio, um feito notável para a época.
Partículas Subatômicas no Modelo de Bohr
Segundo Bohr, o átomo é composto por três partículas subatômicas: prótons, nêutrons e elétrons. Cada uma dessas partículas possui características distintas em termos de carga e massa. Os prótons, partículas carregadas positivamente, residem no núcleo atômico, juntamente com os nêutrons, partículas sem carga elétrica. Os elétrons, partículas carregadas negativamente, orbitam o núcleo em níveis de energia discretos. A massa de um próton é aproximadamente igual à massa de um nêutron, sendo ambas significativamente maiores que a massa de um elétron.
Esta distinção de massa e carga é fundamental para a compreensão do comportamento atômico.
Diagrama do Átomo de Hidrogênio segundo Bohr

Para ilustrar a simplicidade e elegância do modelo, apresentamos um diagrama do átomo de hidrogênio. O átomo de hidrogênio, o mais simples de todos os átomos, possui apenas um próton no núcleo e um elétron orbitando-o.
Legenda: O círculo vermelho representa o núcleo do átomo de hidrogênio, contendo um próton. O círculo azul menor representa o elétron orbitando o núcleo em sua órbita mais próxima.
Comparação da Composição Atômica de Bohr com a Composição Atual

Embora o modelo de Bohr tenha sido um avanço significativo, ele apresenta limitações. A principal diferença entre o modelo de Bohr e a compreensão atual da estrutura atômica reside na descrição do movimento eletrônico. Bohr propôs órbitas eletrônicas bem definidas, como planetas orbitando o sol. A mecânica quântica, no entanto, descreve os elétrons como tendo uma natureza dual, onda-partícula, ocupando orbitais com probabilidades de localização, e não trajetórias precisas.
Apesar disso, a ideia de níveis de energia discretos, introduzida por Bohr, permanece válida na física moderna.
Semelhanças: Ambos os modelos reconhecem a existência de prótons, nêutrons e elétrons como constituintes fundamentais do átomo. Ambos também concordam com a ideia de que os elétrons ocupam regiões ao redor do núcleo. A principal diferença está na descrição do movimento e localização dos elétrons. O modelo de Bohr descreve órbitas circulares bem definidas, enquanto a mecânica quântica descreve orbitais com probabilidades de encontrar o elétron em diferentes regiões do espaço.
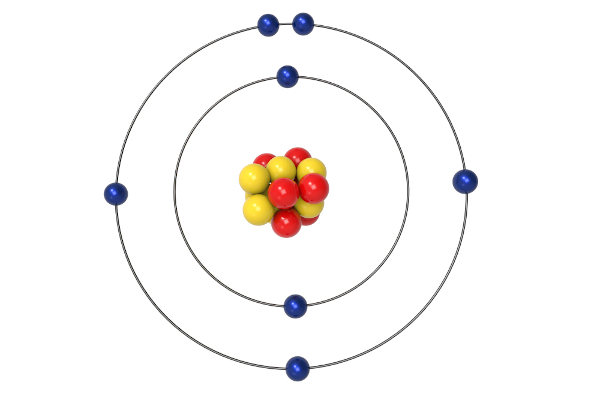
Representação do Átomo de Hélio segundo Bohr
O átomo de hélio, com dois prótons e dois nêutrons no núcleo e dois elétrons na eletrosfera, oferece uma ilustração mais complexa do modelo de Bohr. Neste modelo simplificado, os dois elétrons ocupam a mesma órbita mais próxima do núcleo.
Descrição da Imagem: O círculo vermelho representa o núcleo do átomo de hélio, contendo dois prótons e dois nêutrons. Os dois círculos azuis menores representam os dois elétrons orbitando o núcleo na mesma órbita, a mais próxima possível do núcleo. Note que, na realidade, a representação de dois elétrons na mesma órbita é uma simplificação do modelo de Bohr.
Exercícios e Aplicações do Modelo Atômico de Bohr: Modelo Atômico De Bohr – Características, Composição E Exercícios

O modelo atômico de Bohr, apesar de suas limitações, permanece um marco fundamental na compreensão da estrutura atômica, oferecendo uma ferramenta poderosa para a visualização e o cálculo de propriedades atômicas, especialmente em átomos simples como o hidrogênio. Sua elegância reside na capacidade de explicar o espectro de emissão atômica e prever as energias das transições eletrônicas. A jornada para desvendar os mistérios da matéria encontra neste modelo um ponto de referência inestimável, mesmo que a física quântica tenha revelado uma realidade mais complexa e sutil.
O Espectro de Emissão do Hidrogênio
O modelo de Bohr explica brilhantemente o espectro de emissão do hidrogênio, um conjunto discreto de linhas coloridas observadas quando átomos de hidrogênio excitados retornam ao seu estado fundamental. A chave está na quantização da energia eletrônica: os elétrons só podem ocupar órbitas específicas com energias definidas. Ao saltar de uma órbita de maior energia para outra de menor energia, o elétron emite um fóton com energia exatamente igual à diferença entre as energias das duas órbitas.
Essa energia corresponde a uma frequência específica de luz, gerando as linhas discretas do espectro. A fórmula de Rydberg, derivada do modelo de Bohr, permite calcular o comprimento de onda dessas linhas com notável precisão:
1/λ = RH (1/n 1²1/n 2²)
onde λ é o comprimento de onda, R H é a constante de Rydberg para o hidrogênio, e n 1 e n 2 são os números quânticos principais das órbitas inicial e final, respectivamente. Cada linha espectral corresponde a uma transição específica entre níveis de energia.
Cálculos de Energia e Frequência de Fótons
O modelo de Bohr permite calcular a energia de um elétron em uma órbita específica e a energia do fóton emitido ou absorvido durante uma transição eletrônica. A energia de um elétron na n-ésima órbita do átomo de hidrogênio é dada por:
En = -R H/n²
onde R H é a constante de Rydberg (aproximadamente 2,18 x 10 -18 J) e n é o número quântico principal. A energia do fóton emitido ou absorvido durante uma transição entre os níveis n 2 e n 1 é então:
ΔE = En2E n1 = hν
onde h é a constante de Planck (6,63 x 10 -34 Js) e ν é a frequência do fóton. Por exemplo, a transição do nível n=3 para n=2 no hidrogênio resulta na emissão de um fóton na região visível do espectro (linha vermelha da série de Balmer).
Limitações do Modelo de Bohr e suas Implicações
Apesar de seu sucesso em explicar o espectro do hidrogênio, o modelo de Bohr apresenta limitações significativas. Ele falha ao descrever adequadamente átomos com mais de um elétron, não consegue prever a intensidade das linhas espectrais e não explica o efeito Zeeman (o desdobramento das linhas espectrais em um campo magnético). Essas limitações revelam a necessidade de uma descrição mais completa e sofisticada da estrutura atômica, fornecida pela mecânica quântica, que abandona a ideia de órbitas eletrônicas bem definidas em favor de orbitais probabilísticos.
A mecânica quântica fornece uma descrição mais precisa e abrangente do comportamento dos elétrons nos átomos, superando as limitações do modelo de Bohr.
Exercício Prático: Formação de Íons com o Modelo de Bohr, Modelo Atômico De Bohr – Características, Composição E Exercícios
Para compreender a formação de íons utilizando o modelo de Bohr, é crucial visualizar a remoção ou adição de elétrons e o consequente impacto nos níveis de energia. A seguinte atividade prática ilustra esse processo:
- Considere um átomo de sódio (Na), com 11 elétrons. Utilize o modelo de Bohr para representar a distribuição eletrônica em seus níveis de energia.
- Identifique o elétron de valência (o elétron mais externo) no diagrama de Bohr do sódio.
- Para formar o íon Na +, remova o elétron de valência do diagrama. Mostre a nova configuração eletrônica do íon.
- Explique como a remoção do elétron afeta a energia total do átomo e a estabilidade do íon formado. Considere a estabilidade da configuração eletrônica resultante.
- Compare a energia de ionização do sódio com a de outros elementos, relacionando-a com a sua posição na tabela periódica e a sua configuração eletrônica.

