Estabeleça As Relações Entre A Geometria Molecular E Seus Exemplos é um tópico fundamental na química, que nos permite entender como a disposição dos átomos em uma molécula influencia suas propriedades e reatividade. Imagine um quebra-cabeça tridimensional, onde cada peça representa um átomo e a forma final determina como a molécula interage com outras.
A geometria molecular é a chave para desvendar este quebra-cabeça, revelando a estrutura e o comportamento de moléculas em diferentes contextos, desde reações químicas até a formação de materiais complexos.
A geometria molecular é definida pela posição relativa dos núcleos atômicos em uma molécula, e é determinada por fatores como a repulsão entre os pares de elétrons ao redor do átomo central. Essa disposição espacial dos átomos influencia diretamente as propriedades físicas e químicas da molécula, como seu ponto de fusão, ponto de ebulição, solubilidade, polaridade e reatividade.
A geometria molecular é, portanto, um conceito essencial para entender o comportamento de compostos químicos e para o desenvolvimento de novas tecnologias.
Introdução à Geometria Molecular
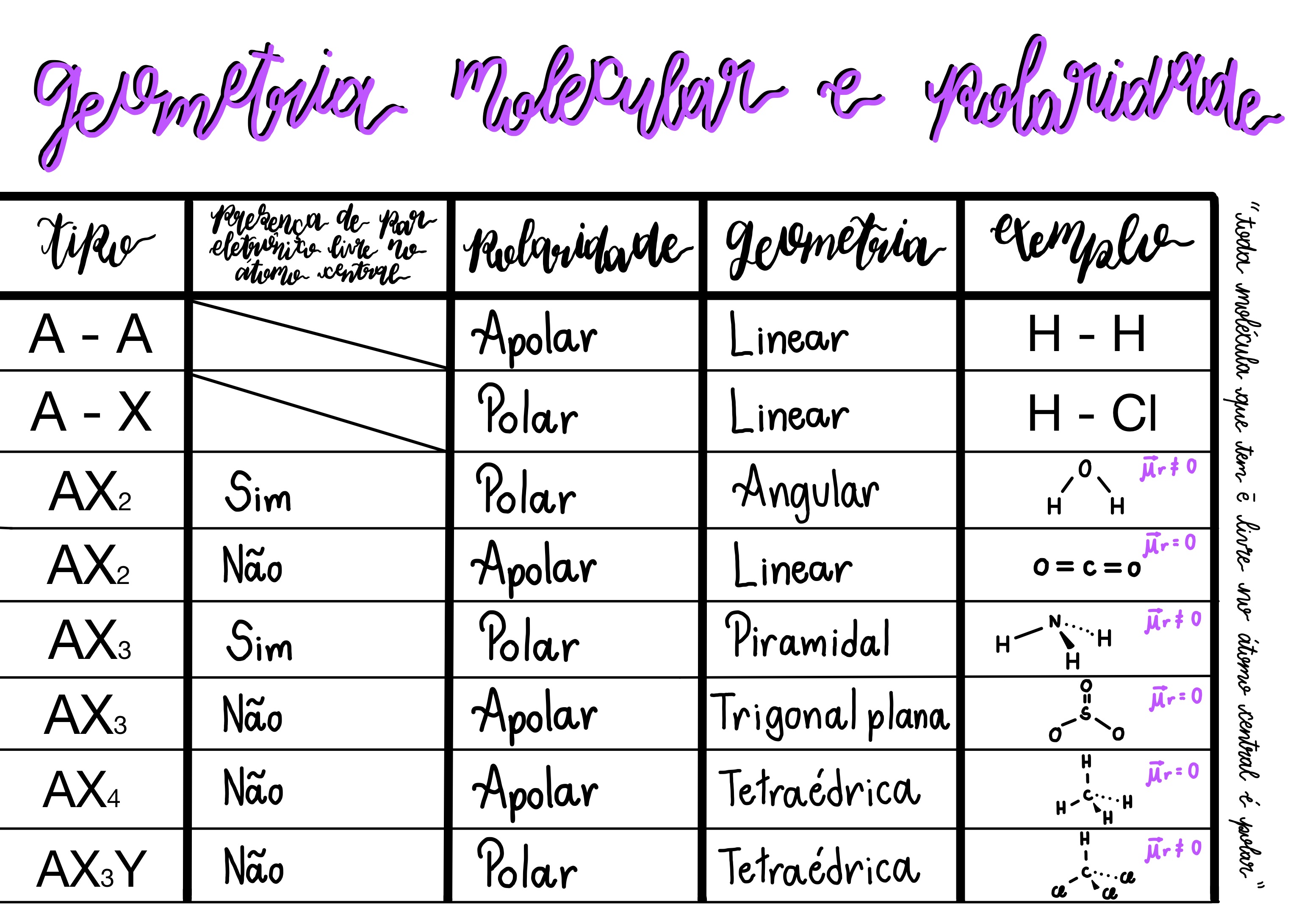
A geometria molecular é um conceito fundamental na química que descreve a disposição tridimensional dos átomos em uma molécula. Compreender a geometria molecular é crucial para entender as propriedades físicas e químicas de uma substância, como reatividade, polaridade, ponto de ebulição e solubilidade.A geometria molecular é determinada pela repulsão entre os pares de elétrons ao redor do átomo central.
Essa repulsão, conhecida como teoria da repulsão dos pares de elétrons da camada de valência (VSEPR), é o principal fator que influencia a forma de uma molécula.
A influência da geometria molecular nas propriedades das moléculas
A geometria molecular influencia diretamente as propriedades de uma molécula, impactando sua reatividade, polaridade e interações intermoleculares.
- Reatividade:A forma de uma molécula determina quais sítios são acessíveis para a reação. Por exemplo, uma molécula linear, como o CO 2, é mais reativa em seus polos, enquanto uma molécula tetraédrica, como o CH 4, é mais reativa em seus vértices.
- Polaridade:A geometria molecular influencia a distribuição de elétrons em uma molécula. Moléculas com geometrias assimétricas, como a água (H 2O), são polares, pois a distribuição de elétrons é desigual, criando um momento dipolar. Moléculas com geometrias simétricas, como o metano (CH 4), são apolares, pois a distribuição de elétrons é uniforme.
- Interações intermoleculares:A geometria molecular afeta o tipo e a força das interações intermoleculares entre moléculas. Moléculas polares podem formar ligações de hidrogênio, que são mais fortes do que as forças de Van der Waals presentes em moléculas apolares.
Exemplos de como a geometria molecular afeta a reatividade e as interações intermoleculares
- Água (H2O): A geometria angular da água, com seus dois pares de elétrons não compartilhados, torna a molécula polar, permitindo a formação de ligações de hidrogênio. Essas ligações de hidrogênio são responsáveis pelo alto ponto de ebulição da água e sua capacidade de dissolver muitas substâncias polares.
- Metano (CH4): O metano tem uma geometria tetraédrica, com quatro ligações C-H igualmente distribuídas. Essa simetria resulta em uma molécula apolar, com interações intermoleculares fracas. Isso explica o baixo ponto de ebulição do metano.
- Dióxido de carbono (CO2): O dióxido de carbono tem uma geometria linear, com dois pares de elétrons duplos localizados nos polos. Essa geometria permite que o CO 2dissolva-se em água, formando ácido carbônico (H 2CO 3), responsável pela acidez da água da chuva.
Teoria da Ligação de Valência (TLV): Estabeleça As Relações Entre A Geometria Molecular E Seus Exemplos
A Teoria da Ligação de Valência (TLV) é um modelo que descreve a formação de ligações químicas entre átomos e como essa formação influencia a geometria molecular. Ela explica como os elétrons de valência, ou seja, os elétrons no nível de energia mais externo de um átomo, interagem para formar ligações covalentes.
Hibridização de Orbitais Atômicos
A TLV propõe que os orbitais atômicos de um átomo se combinam para formar novos orbitais híbridos, que são responsáveis pelas ligações químicas. Essa hibridização permite que os orbitais se sobreponham de forma mais eficiente, resultando em ligações mais fortes e geometrias moleculares específicas.
- Hibridização sp3: Um átomo com um orbital s e três orbitais p se combinam para formar quatro orbitais híbridos sp 3, que são direcionados para os vértices de um tetraedro. Esse tipo de hibridização é comum em moléculas como o metano (CH 4).
- Hibridização sp2: Um átomo com um orbital s e dois orbitais p se combinam para formar três orbitais híbridos sp 2, que estão localizados no mesmo plano e formam ângulos de 120° entre si. O orbital p restante permanece puro e é perpendicular ao plano dos orbitais híbridos.
Esse tipo de hibridização é comum em moléculas como o etileno (C 2H 4).
- Hibridização sp: Um átomo com um orbital s e um orbital p se combinam para formar dois orbitais híbridos sp, que são lineares e formam um ângulo de 180° entre si. Os orbitais p restantes permanecem puros e são perpendiculares ao eixo dos orbitais híbridos.
Esse tipo de hibridização é comum em moléculas como o acetileno (C 2H 2).
Previsão da Geometria Molecular, Estabeleça As Relações Entre A Geometria Molecular E Seus Exemplos
A TLV permite prever a geometria de uma molécula com base no número de ligações e pares de elétrons livres ao redor do átomo central. A geometria é determinada pela disposição espacial dos orbitais híbridos, que minimizam a repulsão entre os pares de elétrons.
Exemplo 1: Metano (CH4) O átomo de carbono no metano tem quatro elétrons de valência, que se combinam com os orbitais 1s dos átomos de hidrogênio para formar quatro ligações covalentes. A TLV prevê que o carbono sofrerá hibridização sp 3, formando quatro orbitais híbridos sp 3, que se direcionam para os vértices de um tetraedro.
A geometria molecular do metano é tetraédrica, com ângulos de ligação de 109,5°.
Exemplo 2: Água (H2O) O átomo de oxigênio na água tem seis elétrons de valência, dois dos quais formam ligações covalentes com os átomos de hidrogênio. Os dois pares de elétrons restantes são pares de elétrons livres. A TLV prevê que o oxigênio sofrerá hibridização sp 3, formando quatro orbitais híbridos sp 3, dois dos quais se ligam aos átomos de hidrogênio e os outros dois são ocupados pelos pares de elétrons livres.
A geometria molecular da água é angular, com ângulos de ligação de aproximadamente 104,5°. A repulsão entre os pares de elétrons livres é maior do que a repulsão entre os pares de ligação, o que causa uma diminuição no ângulo de ligação.
Geometrias Moleculares Comuns
A geometria molecular descreve a disposição espacial dos átomos em uma molécula. Esta disposição é crucial para determinar as propriedades físicas e químicas da molécula, como polaridade, reatividade e ponto de ebulição. Existem diversas geometrias moleculares possíveis, cada uma com características únicas.
Geometrias Moleculares Comuns
A geometria molecular é determinada pelo número de pares de elétrons ao redor do átomo central, incluindo pares de ligação e pares de elétrons não compartilhados.
- Linear: Moléculas lineares possuem dois átomos ligados ao átomo central, com um ângulo de ligação de 180°. Exemplos: CO 2, BeCl 2, e HCN.
- Angular: Moléculas angulares possuem dois átomos ligados ao átomo central, com um ângulo de ligação menor que 180°. A presença de pares de elétrons não compartilhados no átomo central causa uma repulsão que reduz o ângulo de ligação. Exemplos: H 2O, SO 2e O 3.
- Trigonal Planar: Moléculas trigonais planares possuem três átomos ligados ao átomo central, com um ângulo de ligação de 120°. Exemplos: BF 3, SO 3e NO 3–.
- Tetraédrica: Moléculas tetraédricas possuem quatro átomos ligados ao átomo central, com um ângulo de ligação de 109,5°. Exemplos: CH 4, SiCl 4e NH 4+.
- Piramidal Trigonal: Moléculas piramidais trigonais possuem quatro átomos ligados ao átomo central, com um ângulo de ligação menor que 109,5°. A presença de um par de elétrons não compartilhado no átomo central causa uma repulsão que reduz o ângulo de ligação.
Exemplos: NH 3, PCl 3e AsH 3.
- Bipiramidal Trigonal: Moléculas bipiramidais trigonais possuem cinco átomos ligados ao átomo central, com três átomos em um plano triangular e dois átomos em posições axiais. Exemplos: PCl 5, SF 4e BrF 5.
- Octaédrica: Moléculas octaédricas possuem seis átomos ligados ao átomo central, com um ângulo de ligação de 90°. Exemplos: SF 6, XeF 6e [Co(NH 3) 6] 3+.
Influência da Geometria Molecular nas Propriedades
A geometria molecular de uma molécula tem um impacto significativo em suas propriedades físicas e químicas. A forma de uma molécula determina como ela interage com outras moléculas, afetando suas propriedades como ponto de fusão, ponto de ebulição, solubilidade, polaridade e reatividade.
Ponto de Fusão e Ebulição
O ponto de fusão e o ponto de ebulição são propriedades físicas que descrevem a temperatura em que uma substância muda de estado físico. Moléculas com geometrias diferentes exibem diferentes pontos de fusão e ebulição devido à força das interações intermoleculares entre elas.
Moléculas com geometrias que permitem interações intermoleculares mais fortes, como ligações de hidrogênio, tendem a ter pontos de fusão e ebulição mais altos. Por exemplo, a água (H 2O) tem uma geometria angular que permite a formação de ligações de hidrogênio fortes, resultando em um ponto de ebulição relativamente alto (100 °C).
Em contraste, o metano (CH 4), que tem uma geometria tetraédrica, não forma ligações de hidrogênio e tem um ponto de ebulição muito mais baixo (-161,5 °C).
Solubilidade
A solubilidade se refere à capacidade de uma substância se dissolver em outra. A geometria molecular desempenha um papel importante na solubilidade, pois influencia a capacidade de uma molécula se dissolver em um solvente específico. Moléculas polares tendem a ser solúveis em solventes polares, enquanto moléculas apolares tendem a ser solúveis em solventes apolares.
Por exemplo, o açúcar (C 12H 22O 11) é uma molécula polar e é solúvel em água, que também é um solvente polar. O óleo, por outro lado, é uma molécula apolar e é solúvel em solventes apolares como o éter dietílico.
Polaridade
A polaridade de uma molécula se refere à distribuição desigual de densidade eletrônica na molécula. A geometria molecular pode influenciar a polaridade de uma molécula, pois determina a localização dos átomos e, portanto, a distribuição dos elétrons. Moléculas com geometrias simétricas tendem a ser apolares, enquanto moléculas com geometrias assimétricas tendem a ser polares.
Por exemplo, o dióxido de carbono (CO 2) tem uma geometria linear e é apolar, enquanto a água (H 2O) tem uma geometria angular e é polar.
Reatividade
A reatividade de uma molécula se refere à sua capacidade de participar de reações químicas. A geometria molecular pode influenciar a reatividade de uma molécula, pois determina a localização dos átomos e, portanto, a acessibilidade dos sítios reativos. Moléculas com geometrias que expõem os sítios reativos tendem a ser mais reativas do que moléculas com geometrias que escondem os sítios reativos.
Por exemplo, o eteno (C 2H 4) tem uma geometria planar e é mais reativo do que o etano (C 2H 6), que tem uma geometria tetraédrica.
Aplicações da Geometria Molecular

A geometria molecular é um conceito fundamental na química que tem aplicações vastas e importantes em diversas áreas da química, impactando o desenvolvimento de novos materiais e medicamentos. A compreensão da forma e disposição espacial dos átomos em uma molécula fornece informações cruciais sobre as propriedades e reatividade das moléculas, permitindo a previsão e manipulação de seus comportamentos.
Aplicações em Diferentes Áreas da Química
A geometria molecular é uma ferramenta poderosa que molda o entendimento da química, impactando áreas como:
- Química Orgânica:A geometria molecular é essencial para entender as reações de adição, substituição e eliminação, bem como a reatividade de moléculas orgânicas. A disposição espacial dos átomos em uma molécula orgânica determina quais regiões são mais suscetíveis ao ataque por reagentes.
Por exemplo, a geometria tetraédrica do metano (CH 4) explica por que ele é um composto relativamente inerte, enquanto a geometria plana trigonal do etileno (C 2H 4) explica sua reatividade em reações de adição.
- Química Inorgânica:A geometria molecular é fundamental para entender a estrutura e reatividade de compostos inorgânicos, como complexos de coordenação. A geometria do complexo de coordenação determina o número de ligantes que podem se coordenar ao íon metálico central, influenciando suas propriedades e reatividade.
A geometria também pode ser usada para prever a estabilidade e reatividade de compostos inorgânicos. Por exemplo, a geometria tetraédrica do íon tetracloroaurato(III) ([AuCl 4] –) explica sua estabilidade e reatividade em soluções aquosas.
- Química Biológica:A geometria molecular desempenha um papel crucial na bioquímica, influenciando a estrutura e função de biomoléculas, como proteínas e ácidos nucléicos. A geometria molecular das proteínas determina sua forma tridimensional, que é crucial para sua função específica. Por exemplo, a geometria molecular das enzimas permite que elas se liguem a substratos específicos, catalisando reações biológicas.
A geometria do DNA também é fundamental para sua função de armazenamento e transmissão de informação genética.
- Química Industrial:A geometria molecular é um fator importante no desenvolvimento de novos materiais e processos industriais. A compreensão da geometria molecular permite o projeto de catalisadores eficientes, polímeros com propriedades específicas e novos materiais com propriedades otimizadas. Por exemplo, a geometria molecular de catalisadores é crucial para sua atividade e seletividade em reações químicas industriais.
Importância para o Desenvolvimento de Novos Materiais e Medicamentos
A compreensão da geometria molecular é essencial para o desenvolvimento de novos materiais e medicamentos. A forma e disposição espacial dos átomos em uma molécula influenciam suas propriedades, como polaridade, ponto de fusão, ponto de ebulição, solubilidade e reatividade.
A geometria molecular pode ser usada para projetar moléculas com propriedades específicas, como resistência a altas temperaturas, condutividade elétrica, biocompatibilidade e atividade farmacológica.
A geometria molecular é usada para projetar medicamentos que se ligam a alvos específicos no corpo, como proteínas ou enzimas, e exercem efeitos terapêuticos específicos. A geometria molecular é também crucial para o desenvolvimento de novos materiais com propriedades otimizadas, como resistência, flexibilidade, condutividade e capacidade de absorção de luz.
Ao compreender as relações entre a geometria molecular e seus exemplos, abrimos portas para um mundo de possibilidades. Podemos prever o comportamento de moléculas, projetar novos materiais com propriedades específicas e até mesmo entender os mecanismos de reações químicas complexas.
A geometria molecular é um conceito fundamental que nos permite desvendar os segredos do mundo microscópico e aplicar esse conhecimento para resolver problemas do mundo real.

