Cite Um Exemplo Indentificando Uma Ligação Covalente E Uma Iônica: Já se perguntou como átomos se unem para formar as substâncias que conhecemos? A resposta está nas ligações químicas! Neste post, vamos mergulhar no fascinante mundo das ligações covalentes e iônicas, explorando suas diferenças, características e, claro, ilustrando com exemplos práticos para facilitar a compreensão. Preparado para desvendar os segredos da química?
Vamos começar definindo o básico: ligações covalentes envolvem o compartilhamento de elétrons entre átomos, geralmente não metais, formando moléculas. Já as ligações iônicas acontecem pela transferência de elétrons de um átomo para outro, geralmente entre um metal e um não metal, resultando em íons com cargas opostas que se atraem, formando compostos iônicos. A eletronegatividade, que mede a capacidade de um átomo atrair elétrons em uma ligação, desempenha um papel crucial na determinação do tipo de ligação formada.
Uma grande diferença de eletronegatividade indica uma ligação iônica, enquanto uma pequena diferença sugere uma ligação covalente.
Ligações Químicas: Covalente x Iônica – Uma Aventura Radicaismente Explicativa: Cite Um Exemplo Indentificando Uma Ligação Covalente E Uma Iônica
E aí, galera! Preparados para mergulhar no mundo microscópico das ligações químicas? Se você já se perguntou como átomos se juntam para formar tudo o que existe ao nosso redor, este é o seu guia definitivo (e bem humorado, claro). Vamos desvendar o mistério das ligações covalentes e iônicas, sem jargões chatos, só com a verdade nua e crua (ou melhor, com elétrons compartilhados e íons interagindo!).
Conceitos Básicos de Ligações Químicas
A química, meus amigos, é uma grande festa de átomos. Esses caras, para ficarem mais estáveis, adoram se juntar. A forma como eles fazem isso define o tipo de ligação. A principal diferença entre ligações covalentes e iônicas está na maneira como os elétrons são tratados: nas covalentes, os elétrons são compartilhados entre os átomos; nas iônicas, um átomo “doa” elétrons para outro, formando íons com cargas opostas que se atraem.
Eletronegatividade é a capacidade de um átomo atrair elétrons em uma ligação. Se a diferença de eletronegatividade entre dois átomos for grande, a ligação será iônica (um átomo “rouba” elétrons do outro). Se a diferença for pequena, a ligação será covalente (os átomos compartilham os elétrons mais ou menos igualmente). Uma molécula é um grupo de átomos unidos por ligações covalentes, enquanto um composto iônico é formado por íons unidos por forças eletrostáticas.
Ligação Covalente: Exemplos e Características
Nas ligações covalentes, os átomos se unem compartilhando elétrons, criando uma força de atração que mantém a molécula unida. A força dessa ligação depende da polaridade: moléculas polares têm ligações mais fortes devido à diferença de eletronegatividade entre os átomos, enquanto moléculas apolares têm ligações mais fracas, pois os átomos compartilham elétrons de forma mais equitativa.
| Molécula | Fórmula | Estrutura de Lewis | Tipo de ligação |
|---|---|---|---|
| Água | H₂O | H-O-H (com dois pares de elétrons não ligantes no oxigênio) | Covalente Polar |
| Metano | CH₄ | C no centro, com quatro H ligados a ele, cada ligação representando um par de elétrons compartilhados. | Covalente Apolar |
| Dióxido de Carbono | CO₂ | O=C=O (cada ligação dupla representa dois pares de elétrons compartilhados) | Covalente Apolar |
Ligação Iônica: Exemplos e Características
Já nas ligações iônicas, a paixão é mais… explosiva! Átomos com eletronegatividades muito diferentes trocam elétrons, criando íons com cargas opostas que se atraem eletrostaticamente, formando um cristal iônico. É como um ímã gigante, só que com íons.
- Cloreto de Sódio (NaCl): Íons Na⁺ e Cl⁻.
- Óxido de Cálcio (CaO): Íons Ca²⁺ e O²⁻.
- Cloreto de Magnésio (MgCl₂): Íons Mg²⁺ e Cl⁻.
Compostos iônicos geralmente têm altos pontos de fusão e ebulição, são solúveis em água e conduzem eletricidade quando dissolvidos ou fundidos, diferente dos compostos covalentes que, em geral, possuem pontos de fusão e ebulição mais baixos, são menos solúveis em água e não conduzem eletricidade em solução.
Comparação Direta: Covalente vs. Iônica, Cite Um Exemplo Indentificando Uma Ligação Covalente E Uma Iônica
| Característica | Ligação Covalente | Ligação Iônica | Exemplo |
|---|---|---|---|
| Formação da Ligação | Compartilhamento de elétrons | Transferência de elétrons | – |
| Propriedades dos Compostos | Baixo ponto de fusão/ebulição, geralmente não conduz eletricidade | Alto ponto de fusão/ebulição, conduz eletricidade quando dissolvido ou fundido | – |
| Eletronegatividade | Diferença pequena ou nula | Grande diferença | – |
| Exemplos | Água (H₂O), Metano (CH₄) | Cloreto de Sódio (NaCl), Óxido de Cálcio (CaO) | – |
Em solução aquosa, compostos iônicos se dissociam em íons, conduzindo eletricidade, enquanto compostos covalentes geralmente não se dissociam e, portanto, não conduzem eletricidade. A solubilidade em água também difere: compostos iônicos são geralmente mais solúveis em água do que compostos covalentes.
Exemplo de Identificação: Um Caso Prático
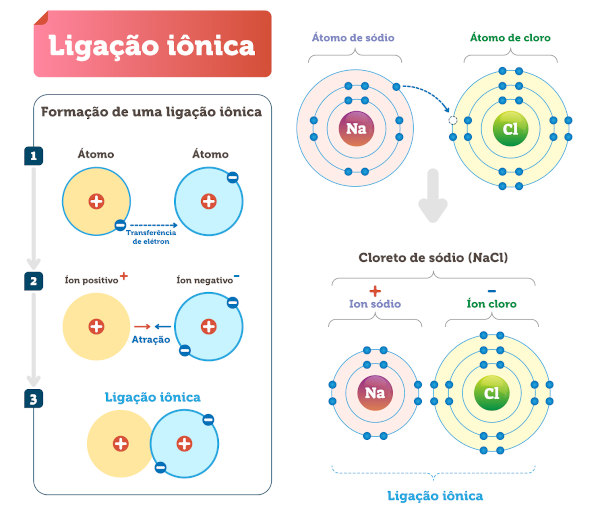
Vamos imaginar a formação de cloreto de sódio (NaCl) a partir de sódio metálico (Na) e gás cloro (Cl₂). É uma reação bem explosiva (literalmente!), então, vamos acompanhar passo a passo, com segurança, claro!
- O sódio (Na) tem um elétron na camada de valência, enquanto o cloro (Cl) precisa de um elétron para completar sua camada de valência.
- O átomo de sódio “doa” seu elétron de valência para um átomo de cloro.
- Isso forma um íon sódio positivo (Na⁺) e um íon cloreto negativo (Cl⁻).
- A atração eletrostática entre os íons Na⁺ e Cl⁻ forma a ligação iônica, resultando no composto iônico NaCl.
Neste exemplo, a ligação iônica é formada pela transferência de elétrons do sódio para o cloro, enquanto a molécula de cloro (Cl₂) apresenta uma ligação covalente, pois os dois átomos de cloro compartilham um par de elétrons.
Representação Visual das Ligações
Visualizar essas ligações é fundamental! Em uma molécula covalente, como a água (H₂O), podemos ver os átomos de hidrogênio ligados ao átomo de oxigênio através de ligações covalentes, com os elétrons compartilhados entre eles. A geometria molecular da água é angular, devido aos pares de elétrons não-ligantes no oxigênio. Já em um composto iônico, como o NaCl, a representação visual mostra uma estrutura cristalina tridimensional, com os íons Na⁺ e Cl⁻ organizados em uma rede regular, atraídos pelas forças eletrostáticas.
A diferença fundamental é que a ligação covalente envolve o compartilhamento de elétrons entre átomos, resultando em moléculas discretas, enquanto a ligação iônica envolve a transferência de elétrons e a formação de uma rede cristalina iônica.

